جداول تخصصی CLIA برای آزمایشگاهها
قانون CLIA یا Clinical Laboratory Improvement Amendments مجموعهای از مقررات فدرال ایالات متحده است که بهمنظور تضمین دقت، صحت و قابلیت اعتماد نتایج آزمایشهای آزمایشگاهی تدوین شده است.
این قوانین از سال ۱۹۸۸ با هدف یکسانسازی کیفیت عملکرد آزمایشگاههای بالینی در سراسر کشور اجرا شدند و امروزه تقریباً تمام آزمایشگاههایی که نمونههای انسانی را برای تشخیص، پیشگیری یا پایش بیماریها بررسی میکنند، تحت پوشش آن قرار دارند.
بر اساس الزامات CLIA، هر آزمایشگاه موظف است:
-
مجوز معتبر فعالیت (CLIA Certificate) دریافت کند،
-
کارکنان واجد صلاحیت در سطوح مختلف (مدیر، سرپرست، آنالیزور) داشته باشد،
-
روشهای خود را پیش از استفاده تأیید و صحهگذاری کند،
-
در برنامههای Proficiency Testing (PT) شرکت نماید،
-
و سیستمهای کنترل کیفیت داخلی (IQC) و کنترل کیفیت خارجی (EQA) مؤثر را پیادهسازی کند.
اجرای صحیح الزامات CLIA نهتنها برای رعایت قوانین بینالمللی ضروری است، بلکه نقش مهمی در بهبود کیفیت خدمات آزمایشگاهی و افزایش اعتماد پزشکان و بیماران به نتایج آزمایشها دارد.
در این بخش از سایت، مجموعهای از مقالات، بهروزرسانیها و تحلیلهای تخصصی مرتبط با CLIA گردآوری شده است تا مدیران فنی و مسئولان کیفیت بتوانند با آخرین تغییرات و الزامات این مقررات آشنا شوند و فرآیندهای آزمایشگاه خود را بر اساس آن بهروز کنند.
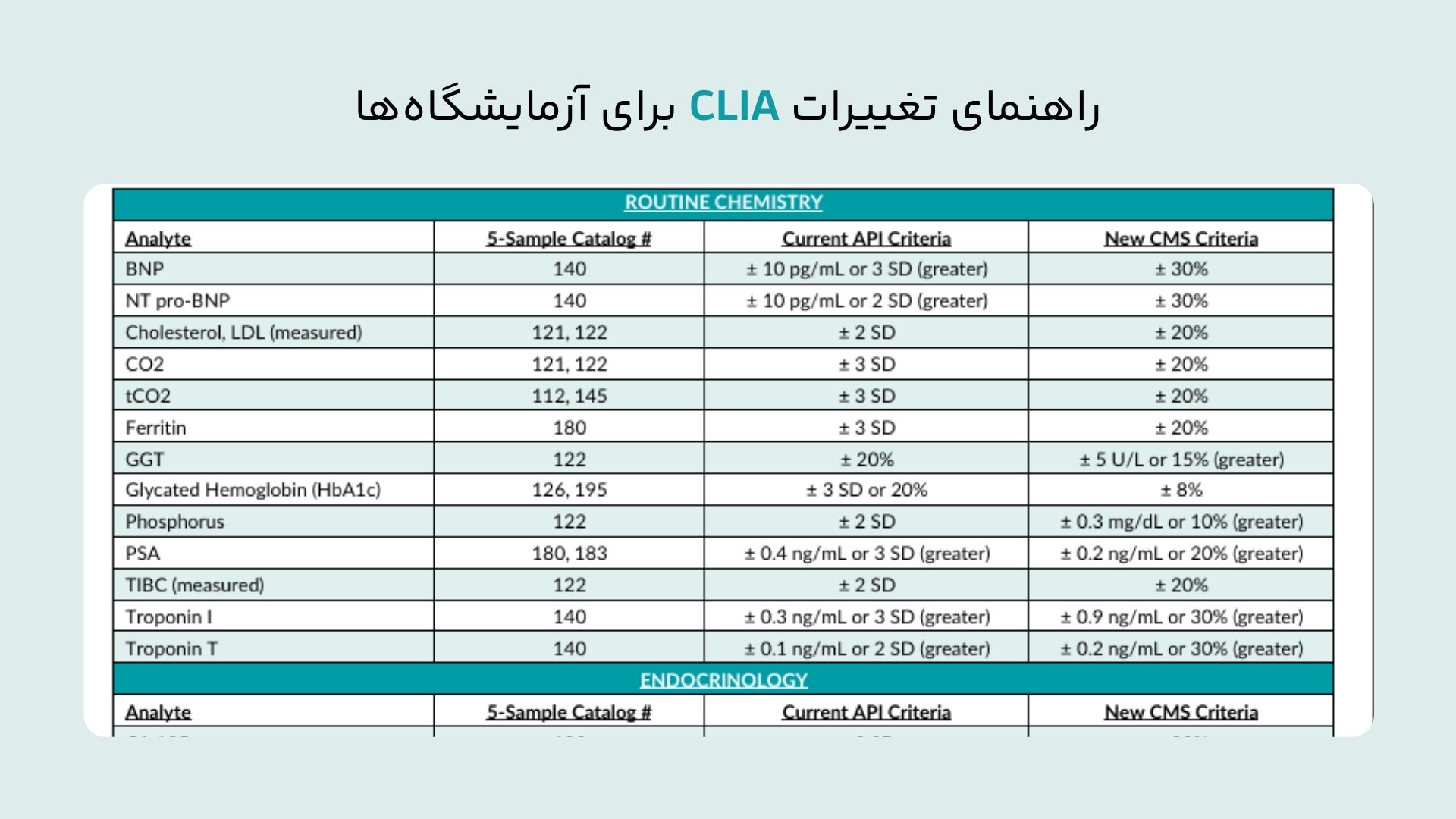
در ادامه، نسخهٔ بهروزشدهٔ مقررات CLIA برای سال ۲۰۲۵ را مشاهده میکنید که شامل تغییرات اعلامشده در برنامههای Proficiency Testing (PT) و حدود مجاز خطاها (TEa) است. مطالعهٔ این سند برای همهٔ آزمایشگاههایی که آزمونهای غیر–waived انجام میدهند توصیه میشود.






دیدگاهتان را بنویسید